再生医療等委員会について
平成26年11月25日に「再生医療等の安全性の確保等に関する法律」(再生医療等安全性確保法)が施行されました。この法律は、再生医療等を提供しようとする機関(再生医療等提供機関)、再生医療等提供計画の審査等機関(認定再生医療等委員会)、特定細胞加工物を製造する施設(特定細胞加工物製造事業者)をすべて届出・認可制にすることにより、再生医療等の安全性を確保することを目的としています。このため、再生医療等に該当する医療の提供する医療機関や細胞培養加工施設に対しては法的な義務が課せられます。
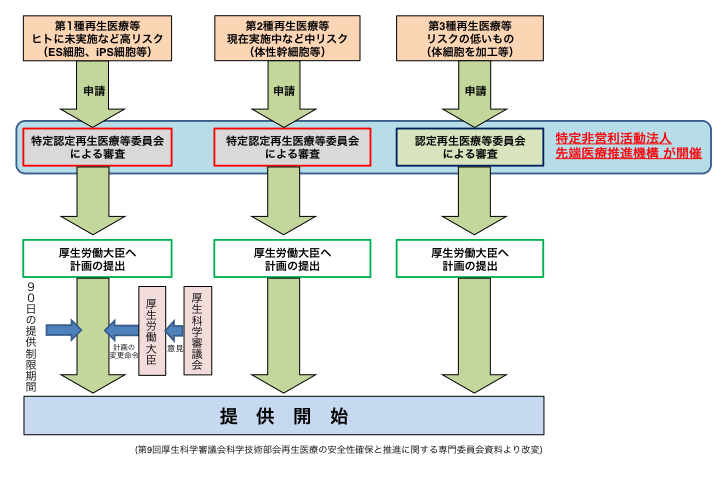
これにより、再生医療等を提供しようとする医療機関においては、そのリスクに応じた再生医療等提供計画を厚生労働大臣または地方厚生局長へ提出する必要があります。
当法人は平成19年より、医療機関から独立した第三者としての治験審査委員会および臨床研究における倫理審査委員会を運営してきた実績があります。このたび、特定認定再生医療等委員会および認定再生医療等委員会の設立を申請し、平成27年4月から東京および名古屋で毎月1回で審査を行ってまいりました。
つきましては、医療機関からの再生医療等提供計画の審査依頼を随時受け付けております。
当委員会について動画で紹介しています。ぜひ一度ご覧ください。
審査依頼はこちら
各審査委員会の実績(開催件数・審査受託件数等)は下記の通りです。
| 委員会名称 | 設立年月 | 認定番号 | 開催件数※1 | 審査受託件数※2 |
|---|---|---|---|---|
| 特定認定再生医療等委員会名古屋 | 2015年4月 | NA8150002 | 119 | 1,041 |
| 認定再生医療等委員会名古屋 | 2015年4月 | NB4150001 | 118 | 572 |
| 特定認定再生医療等委員会東京 | 2015年7月 | NA8150010 | 49 | 162 |
| 認定再生医療等委員会東京 | 2015年8月 | NB3150006 | 44 | 108 |
※1:2025年5月までの累積開催件数
※2:新規審査、変更審査、定期報告のすべての審査分類(再審査を含む)の合計件数.
| 委員会名称 | 開催期間 | 新規審査※ | 定期報告※ | 変更審査等※ | 合計※ |
|---|---|---|---|---|---|
| 特定認定再生医療等委員会名古屋 | 2015年7月~2025年5月 | 300 | 527 | 214 | 1,041 |
| 認定再生医療等委員会名古屋 | 2015年4月~2025年5月 | 123 | 366 | 83 | 572 |
| 特定認定再生医療等委員会東京 | 2015年8月~2025年5月 | 49 | 85 | 28 | 162 |
| 認定再生医療等委員会東京 | 2015年8月~2025年5月 | 17 | 70 | 21 | 108 |
| 合計 | 489 | 1,048 | 346 | 1,883 | |
※:2025年5月までの累積件数
再生医療を提供しようとする医療機関における手続き
- 再生医療等提供機関の管理者は、あらかじめ再生医療等提供基準に従った再生医療等提供計画を作成し、認定再生医療等委員会の意見を聴いて、厚生労働大臣または地方厚生局長に提出することが義務付けられます。
- 再生医療等提供計画を変更するときには、変更後の再生医療等提供計画を提出しなければいけません。
- 再生医療等提供計画を中止する際には、届出をする必要があります。
- 再生医療等提供計画に記載された再生医療等の提供に起因するものと疑われる疾病等の発生を知ったときは、報告をする必要があります。
- 再生医療等提供計画を厚生労働大臣または地方厚生局長へ提出した日から起算して、1年毎に定期報告を行う必要があります。
※詳細につきましては、厚生労働省ホームページ(再生医療について)をご覧ください。
※各種申請書類の作成は各種申請書作成支援サイトで行えます。
特定細胞加工物を製造しようとする事業者における手続き
再生医療等安全性確保法の施行に伴い、再生医療等の提供を目的とした医療機関外への細胞培養加工の委託が許可制(医療機関の場合には届出)となりました。それに伴い、特定細胞加工物の製造をしようとする者は、特定細胞加工物製造事業者として細胞培養加工施設ごとに、厚生労働大臣に届出等が必要となります。
※詳細につきましては、厚生労働省ホームページ(再生医療について)をご覧ください。
※各種申請書類の作成は各種申請書作成支援サイトで行えます。
お問い合わせ先
※申し訳ありませんが電話でのお問い合わせは受け付けておりません。
FAX: 052-745-6882